|
Le Lasix : ami ou ennemi ?
Thierry Sottiaux - Clinique Notre Dame de Grâce - Gosselies
Le furosémide ou Lasix est le diurétique de référence en pratique clinique quotidienne. Il est essentiellement utilisé dans les situations de « surcharge hydrique » ou lorsque une balance hydrique négative est recherchée. Le Lasix est également utilisé dans l’optique d’améliorer voire de « relancer » la diurèse dans les situations d’oligo-anurie aiguë. Cette dernière indication fait d’ailleurs l’objet de controverses dans la littérature. L’effet diurétique de la molécule résulte d’un effet inhibiteur des mécanismes de ré-absorption ionique dans la branche ascendante de l’anse de Henlé (1).
Le phénomène inhibiteur se déroule au niveau du pôle luminal des cellules ; l’efficacité du furosémide dépend de sa concentration « urinaire » dans l’anse de Henlé. L’effet diurétique est également provoqué par la diminution de la tonicité médullaire interstitielle (résultant de la diminution des mécanismes de ré-absorption au niveau de l’anse) : cette hypotonicité médullaire entraîne une diminution de la ré-absorption d’eau au niveau des tubes collecteurs. L’élimination est rénale (excrétion directe ou après glucuronoconjugaison). L’ototoxicité (acouphènes, surdité) est à craindre lorsque la concentration plasmatique de furosémide dépasse 50µgr/ml ou encore lorsque la dose administrée dépasse 4 mgr/minute.
Une « résistance » au lasix peut être observée (augmentation de la dose nécessaire pour obtenir le même débit urinaire) (1). Le phénomène classiquement décrit de « rétention sodée post-diurétique » résulte d’un mécanisme homéostatique ionique et hydrique, notamment via une activation du système rénine-angiotensine-aldostérone. Cette réaction est secondaire à la déplétion hydrique et sodique induite par le Lasix.
La perfusion continue de Lasix est-elle plus efficace que l’administration par bolus intra-veineux ?
Certaines études (essentiellement conduites dans le cadre de l’insuffisance cardiaque congestive) suggèrent une relation dose/effet plus favorable lors de l’administration de Lasix en perfusion continue comparée à l’administration par injection intra-veineuse directe (2,3,4,5,6). Une méta-analyse récente confirme cette tendance mais les études publiées concernent de petits groupes de patients ou des groupes relativement hétérogènes (7). L’efficacité supérieure de la perfusion continue par rapport l’administration intra-veineuse directe pourrait s’expliquer par une moindre ampleur du réflexe neuro-hormonal et par le maintien en permanence d’une concentration locale suffisante de la molécule. De plus, un « pic » de natriurèse (induite par un bolus) pourrait induire un mécanisme réflexe d’augmentation de ré-absorption sodique tubulaire distale.
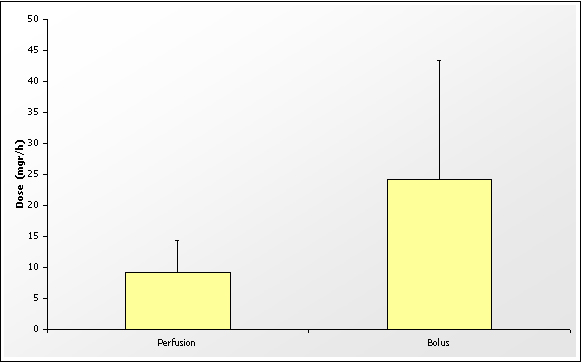
Comparaison des doses de Lasix (mgr/heure) administrées au cours des 24 premières heures pour un objectif d’augmentation de diurèse d’au moins 50% et un minimum de 1 ml/kg/heure chez des patients en surcharge hydrique. D’après Ostermann (3).
Diurétiques et insuffisance rénale aiguë (IRA).
Bien qu’appliquée depuis plus de 40 ans, l’utilisation de furosémide en situation d’IRA (critères généralement mal définis dans les publications) reste sujette à controverses dans la littérature (9,10). L’objectif habituel du clinicien est de transformer une IRA aiguë oligo-anurique en une IRA aiguë à diurèse « conservée » dont le pronostic serait « meilleur ». La deuxième motivation émane de la notion que les diurétiques de l’anse diminuent les besoins en oxygène de l’anse de Henlé (par inhibition de l’activité ATPasique) et pourraient donc avoir un effet protecteur en situation d’hypoxie (8). Les premières études montrent que les diurétiques améliorent le débit urinaire en situations d’IRA ; ils n’influencent cependant pas le pronostic (pas de différence en terme de nombre de patients dialysés, de durée de dialyse, de mortalité) (9).
On note cependant, dès ces premières études, que les patients oligo-anuriques qui récupèrent une diurèse satisfaisante évoluent plus favorablement ; ces patients ont généralement un score de gravité moindre et des paramètres biologiques moins sévères d’IRA (8). Le meilleur pronostic est évidemment observé chez les patients oligo-anuriques qui récupèrent spontanément une diurèse normale (9). Une évaluation prospective large montre que 70% des patients en IRA sont sous diurétiques (et qu’il s’agit de furosémide dans 98% des cas traités) ; cette étude n’observe pas d’effet du traitement diurétique sur la mortalité (12). Une étude de cohorte, publiée en 2002, montre une augmentation de l’incidence de non récupération de la fonction rénale, du séjour hospitalier et de la mortalité hospitalière chez les patients en IRA sous diurétiques (sans protocole d’administration, drogues et posologies très variables) (11). Elément important : le pronostic dépend de la réponse aux diurétiques. La valeur médiane du rapport dose (diurétique)/mL (diurèse) est de 0.34 mg/mL. Le risque de non récupération de la fonction rénale ou de décès est significativement plus important chez les patients « peu répondeurs » et ce risque augmente considérablement avec le temps (risque relatif de 2,94 à J1, 3,6 à J2 et 7,1 à J3) (11).
Selon les méta-analyses les plus récentes (13, 14, 15), les diurétiques ne semblent pas apporter un bénéfice en terme de survie chez les patients en IRA ou à hauts risques d’IRA. La reprise de diurèse sous diurétique constitue plutôt un indicateur de moindre sévérité de l’IRA et se trouve ainsi associée à un meilleur pronostic. A contrario, la persistance d’une anurie sous diurétique –pour laquelle les cliniciens ont tendance à augmenter progressivement les doses de diurétique- est associée à une augmentation de morbidité (oto-toxicité, persistance d’IRA) et de mortalité (13, 14). Il faut évidemment garder en tête les effets potentiels indésirables des diurétiques (diminution de la précharge, immunosuppression) ; ces effets peuvent avoir une influence importante sur les patients en dysfonction multi-organique. En cours d’hémofiltration veino-veineuse (CVVH) ou de dialyse, l’administration de diurétique ne semble pas modifier le pronostic (durée de l’application de la technique, nombre de séances) (16).
Diurétiques et balance hydro-ionique.
Le débat patient « sec » versus patient « humide » est toujours d’actualité. La Société d’Anesthésie de Charleroi a récemment consacré une réunion à ce sujet. La vidéoconférence de cette soirée est disponible sur le site (voir on-line conferences sur la page d’accueil du site). L’ARDS Clinical Trials Network a évalué l’intérêt d’une stratégie hydrique plutôt « restrictive », en comparaison à une stratégie « libérale », chez les patients ALI (Acute Lung Injury) ou ARDS (17). 41% des patients du groupe « restrictif » reçoivent du Lasix (vs 10% dans le groupe libéral) et la dose moyenne journalière de Lasix est de l’ordre de 150 mgr. Il n’y a pas de différence de mortalité entre les deux groupes. Dans le groupe « restrictif », on note une diminution de la durée de ventilation et de séjour USI. On note également dans ce groupe « restrictif », une incidence plus élevée d’alcalose métabolique, et d’hypokaliémie ainsi qu’une tendance à l’hémoconcentration (17). Cette observation souligne ainsi les effets métaboliques possibles d’une thérapie par diurétiques maintenue plusieurs jours. Une hypernatrémie peut être observée (6,17). Cette perturbation métabolique, quelque peu surprenante, résulte probablement d’une déplétion hydrique supérieure à la déplétion sodée ; elle semble être souvent associée à une alcalose hypochlorémique (17).
Conclusion
Le recours au Lasix est fréquent en pratique clinique et, notamment, en USI. Son intérêt pratique concerne essentiellement l’équilibre hydrique des patients, la prévention ou le traitement de la surcharge hydrique, au sens large du terme. L’administration en perfusion continue est préconisée si la dose administrée est supérieure à 10 mgr/heure (1). Une posologie de 10 à 40 mgr/heure est proposée dans les cas sévères et, en raison de la forme sigmoïdale de la relation dose/effet, il pourrait être plus délétère qu’utile d’utiliser des doses supérieures à 40 mgr/heure (1). L’augmentation de diurèse induite par l’administration d’un diurétique signe, bien entendu, l’atteinte de l’objectif recherché. Le clinicien doit cependant surveiller étroitement les conséquences possibles de cette augmentation des pertes hydro-ioniques (hypovolhémie, hémoconcentration, alcalose métabolique, hypokaliémie, hypernatrémie). En situation d’oligo-anurie, après éventuelle correction des facteurs déclenchants, l’administration de diurétiques doit être réalisée sous surveillance étroite en recourrant à des doses plus élevées. L’absence d’effet diurétique après 24 heures de traitement doit inciter à la plus grande prudence. Le recours à des méthodes alternatives doit alors être envisagé.
1. Wang DJ et al : Diuretics : still the mainstay of treatment. Crit Care Med, 2008, 36, S89-S94.
2. Singh NC et al: Comparison of continuous versus intermittent furosemide administration in postoperative pediatric cardiac patients. Crit Care Med, 1992, 20, 17-21.
3. Ostermann M, Alvarez G, Sharpe MD, Martin CM: Frusemide administration in critically ill patients by continuous compared to bolus therapy. Nephron Clin Pract, 2007, 107, c70-c76.
4. Pivac N et al: Diuretic effects of furosemide infusion versus bolus injection in congestive heart failure. Int J Clin Pharmacol Res, 1998, 18, 121-128
5. Licata G et al. Effects of high-doses furosemide and small volume hypertonic saline solution infusion in comparison with a high dose of furosemide as bolus in refractory congestive heart failure: Long-term effects. American Heart Journal 2003;145:459-66.
6. Paterna S et al. Effects of high-dose furosemide and small volume hypertonic saline solution infusion in comparison with a high dose of furosemide as a bolus, in refractory congestive heart failure. European Journal of Heart Failure 2000;2:305-13.
7. Salvador DKR et al: Continuous infusion versus bolus injection of loop diuretics in congestive heart failure. Cochrane Database of Systematic Reviews 2007 Issue 4 (Status: Commented) DOI: 10.1002/14651858.CD003178.pub3
8. Brezis M et al: Determinants of intrarenal oxygenation. Effects of diuretics. Am J Physiol, 1994, 267, F1059-F1068.
9. Shilliday IR et al: Loop diuretics in the management of acute renal failure: a prospective, double-blind, placebo-controlled, randomized study. Nephrol Dial Transplant, 1997, 12, 2592-2596.
10. Cantarovich F et al: High dose frusemide in established acute renal failure. British Med Journal, 1973, 24, 449-450.
11. Mehta RL et al: Diuretics, mortality and nonrecovery of renal function in acute renal failure. JAMA, 2002, 20, 2547-2553.
12. Uchino S et al: Diuretics and mortality in acute renal failure. Crit Care Med, 2004, 32, 1669-1677
13. Ho KM et al: Meta-analysis of frusemide to prevent or treat acute renal failure. BMJ, 2006, 333, 420-426.
14. Sampath S et al: The efficacy of loop diuretics in acute renal failure: assessment using Bayesian evidence synthesis techniques. Crit Care Med, 2007, 35, 2516-2524.
15. Gabshaw S et al: Loop diuretic in the management of acute renal failure: a systematic review and meta-analysis. Crit Care Resusc, 2007, 9, 60-68.
16. Cantarovich F et al: High-dose furosemide for established ARF: a prospective, randomised, double-blind, placebo-controlled, multicenter trial. Am J Kidney Dis, 2004, 44, 402-409.
17. ARDS Clinical Trials Network. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med, 2006, 354, 2564-2575
|


